根据化学方程式的简单计算
课前练习
一.求下列反应中物质间的质量比(H 1 O 16 K 39 Mn 55)
质量比
2 ×(2+16) : 2×1×2 : 16×2
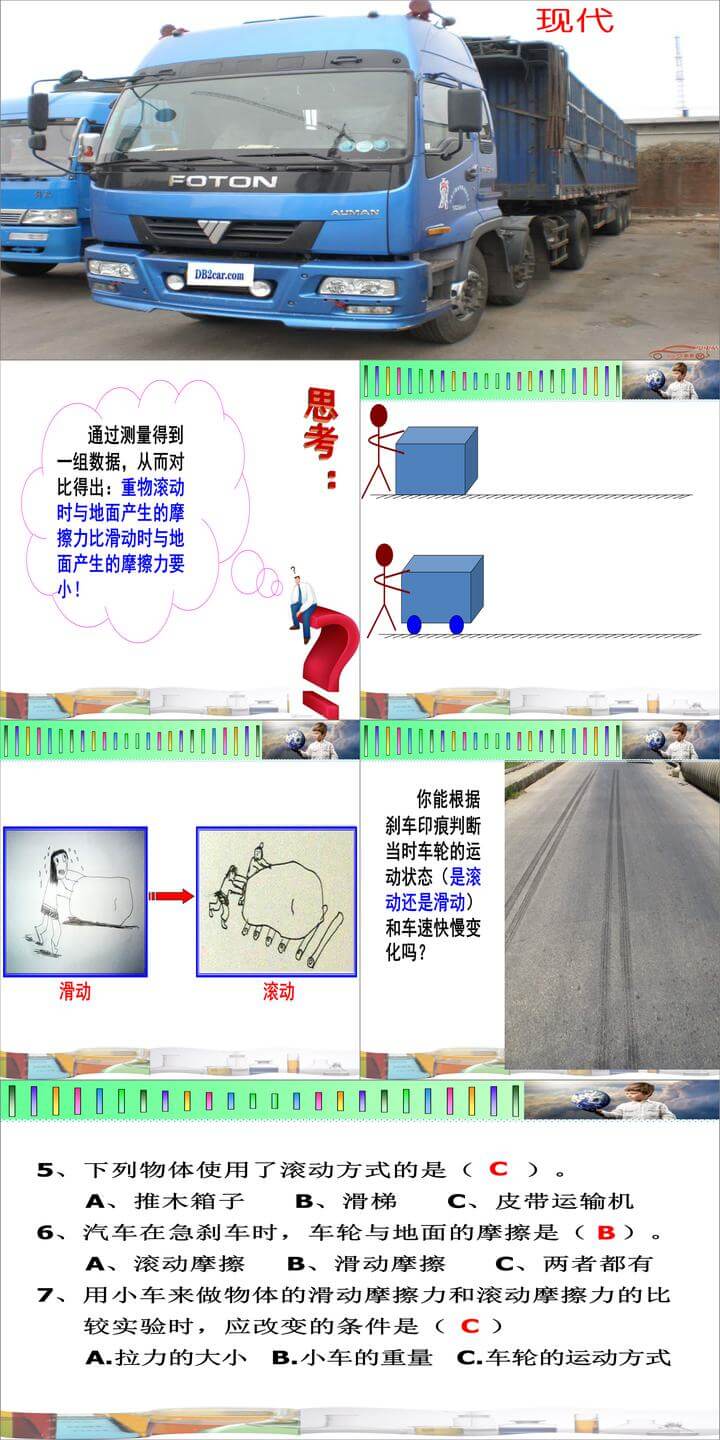
36 : 4 : 32
2×(39+55+16×4) :39+55+16×4 :55+16×2 : 16×2
316 : 197 : 87 :32
“神 舟 五 号” 升 空
你 会 做 吗 ?
你 会 做 吗 ?
假如你是长征系列火箭推 进器的设计师,已知火箭 升空至少要携带100kg的 液氢,充分燃烧才能获得 足够的能量。你会在火箭 助燃仓中填充多少千克的 液氧来满足这些液氢的完 全燃烧?
回 忆……
写出氢气在氧气中燃烧的化学方程式,并标出各物质的质量比可表示为:
2×1×2 :16×2 : 2 ×(2+16)
4 : 32 : 36
若: 4 g : ( )g : ( )g
若: ( ) g : ( ) g : 18 g
若: ( ) g : 64 g : ( ) g
32 32 36 36 16 16 2 2
H—1 O–16 H—1 O–16
8 8 72 72
说明: 在同一化学方程式中,反应物与生成物之间的质量比是固定不变的。相对质量之比等于实际质量之比!
(一)纯净物的计算:
1、已知反应物求生成物
例1)18克水完全电解可产生多少克氢气?(H 1 O 16)
步骤:
解:设产生氢气质量为x
=2g
作答: 产生氢气质量为2g
(1)设未知:(1)设未知:
① 解:设产生氢气质量为x
(2)写化学方程式: (2)写化学方程式:
(3)标出有关物质相对分子质量(不要忘乘前面的化学计量数)及实际质量:
36 4 18g X 36 4 18g X
(4)列比例(纵向比相等),求解:
=2g
④
④
1. 设未知量 2. 写化学方程式 3.标出有关物质的相对分子质量及实际质量 4. 列出比例式、求解 5. 简明地写出答案
1. 设未知量2. 写化学方程式 3.标出有关物质的相对分子质量及实际质量4. 列出比例式、求解5. 简明地写出答案
解:高锰酸钾的质量为x
答:加热632g高锰酸钾,产生64g氧气。
例2)加热多少克高锰酸钾可产生64克氧气?(O 16 K 39 Mn 55)
例2)加热多少克高锰酸钾可产生64克氧气?(O 16 K 39 Mn 55)
解:设能制得氧气的质量为x。
x=9.6g
答:能制得氧气的体积为6.7L。
解:设能制得氧气的质量为x。
例3)用24.5克氯酸钾与二氧化锰混合完全反应能制得多少升氧气?(该氧气标准狀况下的密度为1.43克/升)(Cl-35 O-16 K-39 Mn-55)
例3)用24.5克氯酸钾与二氧化锰混合完全反应能制得多少升氧气?(该氧气标准狀况下的密度为1.43克/升)(Cl-35 O-16 K-39 Mn-55)
x=9.6g
答:能制得氧气的体积为6.7L。
解:设能制得氧气的质量为x。
例4)钛(Ti)和钛合金被认为21世纪的重要金属材料。钛可以通过如下反应制得:TiCl4+ Mg=Ti +2MgCl2 ,若要制的24克钛,需要镁的质量是多少克?(Ti 48 Mg 24 Cl 35.5)
例4)钛(Ti)和钛合金被认为21世纪的重要金属材料。钛可以通过如下反应制得:TiCl4+ Mg=Ti +2MgCl2 ,若要制的24克钛,需要镁的质量是多少克?(Ti 48 Mg 24 Cl 35.5)
答:需要镁的质量为12g。
解:设需要镁的质量为x。
TiCl4 + Mg == Ti + 2MgCl2
TiCl4 + Mg == Ti + 2MgCl2
根据化学方程式计算的注意事项:
(1)设的时候应该用: “设…的质量为x”,无单位
(2)化学方程式书写正确,一定要配平!!
(3)将已知量化成质量单位
(4)列比例式时,竖比=竖比
根据化学方程式计算的注意事项:(1)设的时候应该用: “设…的质量为x”,无单位(2)化学方程式书写正确,一定要配平!!(3)将已知量化成质量单位(4)列比例式时,竖比=竖比
现 在 你 会 做 吗 ?
现 在 你 会 做 吗 ?
假如你是长征系列火箭推进器的设计师,已知火箭升空至少要携带100kg的液氢,充分燃烧才能获得足够的量。你会在火箭助燃仓中填充多少千克的液氧来满足这些液氢的完全燃烧?
解:设完全燃烧100kg液氢所需氧气质量为X
2H2 + O2 点 燃 2H2O
44 32 32
100kg 100kg X X
44 100kg 100kg 32 32 xx
____________________
==
X=800kg
答:完全燃烧100kg液氢所需氧气质量为800kg。
【巩固练习】【巩固练习】
1、6g木炭完全燃烧可生成二氧化碳多少克?(C 12 O 16)
1、6g木炭完全燃烧可生成二氧化碳多少克?(C 12 O 16)
答:需要二氧化碳的质量为22g。
答:需要二氧化碳的质量为22g。
解:设生成二氧化碳的质量为x。
解:设生成二氧化碳的质量为x。
2、已知氯酸钾在加热和二氧化锰的催化作用下生成氯化钾和氧气。现测得反应生成氯化钾7.45g,问已分解的氯酸钾有多少克?放出氧气多少克?(K 39 Cl 35.5 O 16)
2、已知氯酸钾在加热和二氧化锰的催化作用下生成氯化钾和氧气。现测得反应生成氯化钾7.45g,问已分解的氯酸钾有多少克?放出氧气多少克?(K 39 Cl 35.5 O 16)
答:分解的氯酸钾的质量为12.25g,放出氧气的质量为4.8g
答:分解的氯酸钾的质量为12.25g,放出氧气的质量为4.8g
解:设分解的氯酸钾的质量为x,放出氧气的质量为y
解:设分解的氯酸钾的质量为x,放出氧气的质量为y
3、在实验室里电解1.8g水,问要标准状况下可制得氢气多少升?(标准状况下氢气的密度为0.0899 g/L)(H 1 O 16)
3、在实验室里电解1.8g水,问要标准状况下可制得氢气多少升?(标准状况下氢气的密度为0.0899 g/L)(H 1 O 16)
解:设产生氢气质量为x
解:设产生氢气质量为x
36 4 1.8g X 36 4 1.8g X
答:标准状况下可制得氢气2.2L。
答:标准状况下可制得氢气2.2L。
4、88g二氧化碳通入足量的澄清的石灰水(Ca(OH)2)中,可得沉淀(CaCO3)多少克?化学方程式为: CO2 + Ca(OH)2 = CaCO3 ↓ + H2O (C 12 Ca 40 O 16 H 1)
4、88g二氧化碳通入足量的澄清的石灰水(Ca(OH)2)中,可得沉淀(CaCO3)多少克?化学方程式为: CO2 + Ca(OH)2 = CaCO3 ↓ + H2O (C 12 Ca 40 O 16 H 1)
答:可得沉淀的质量为200g。
答:可得沉淀的质量为200g。
解:设可得沉淀CaCO3的质量为x。
解:设可得沉淀CaCO3的质量为x。
CO2 + Ca(OH)2 = CaCO3 ↓ + H2O
CO2 + Ca(OH)2 = CaCO3 ↓ + H2O
例3:A+3B==2C+2D中,A与B的相对分子质量之比为9:11,已知1.8gA与一定量的B恰好完全反应生成5.1gD,则此反应中B和C的质量比为_______
例3:A+3B==2C+2D中,A与B的相对分子质量之比为9:11,已知1.8gA与一定量的B恰好完全反应生成5.1gD,则此反应中B和C的质量比为_______
2:1
2:1
根据化学方程式的计算中,牢记两点:
1、实际质量与系数无关;
2、相对分子质量与系数有关。
因为:物质间的实际质量之比等于相对分子质量与其系数的乘积之比
根据化学方程式的计算中,牢记两点:1、实际质量与系数无关;2、相对分子质量与系数有关。因为:物质间的实际质量之比等于相对分子质量与其系数的乘积之比
例1:把氯酸钾和二氧化锰的混合物16克加热至不再有气体放出,冷却后称得剩余固体质量为11.2克。求:(1)反应所生成的气体的质量;(2)混合物中二氧化锰的质量。
例1:把氯酸钾和二氧化锰的混合物16克加热至不再有气体放出,冷却后称得剩余固体质量为11.2克。求:(1)反应所生成的气体的质量;(2)混合物中二氧化锰的质量。
★解题关键:运用质量守恒定律,正确理解:1、反应前后固体质量为何变化?2、其变量是多少?3、变化量实际上就是哪种物质的质量?
★解题关键:运用质量守恒定律,正确理解:1、反应前后固体质量为何变化?2、其变量是多少?3、变化量实际上就是哪种物质的质量?
能力提升题:2.不纯物质的计算
能力提升题:2.不纯物质的计算
解:⑴根据质量守恒定律可知:m(O2)=16g-11.2g=4.8g
⑵设氯酸钾的质量为x
245 96 x 4.8g
x=12.25g
二氧化锰的质量为:16g-12.25g=3.75g
答:生成氧气的质量为4.8g,二氧化锰的质量为3.75g
解:⑴根据质量守恒定律可知:m(O2)=16g-11.2g=4.8g⑵设氯酸钾的质量为x 245 96 x 4.8g x=12.25g 二氧化锰的质量为:16g-12.25g=3.75g答:生成氧气的质量为4.8g,二氧化锰的质量为3.75g
有一含杂质的的锌8 克与足量的稀硫酸反应共产生0.2克氢气,计算锌的纯度?提示:
有一含杂质的的锌8 克与足量的稀硫酸反应共产生0.2克氢气,计算锌的纯度?提示:
解:设参加反应的锌的质量为x
解:设参加反应的锌的质量为x
65 x
65x
2 0.2g
2 0.2g
答:锌的纯度为81%。
答:锌的纯度为81%。
×
×
3.混合物的计算将5.6g表面已部分氧化的镁带投入到100g稀盐酸中,恰好完全反应,生成氢气0.4g,求:
1)稀盐酸中HCl的质量分数
2)反应后溶液中溶质的质量
3.混合物的计算将5.6g表面已部分氧化的镁带投入到100g稀盐酸中,恰好完全反应,生成氢气0.4g,求:1)稀盐酸中HCl的质量分数2)反应后溶液中溶质的质量
4.多步反应的计算:
已部分变质的Na0H样品13.3g配成溶液,滴入质量分数为14.6%的稀盐酸,生成2.2gCO2,求:
1)生成的Na2CO3的质量多少克?
2)变质的NaOH的质量多少克?
4.多步反应的计算:已部分变质的Na0H样品13.3g配成溶液,滴入质量分数为14.6%的稀盐酸,生成2.2gCO2,求:1)生成的Na2CO3的质量多少克?2)变质的NaOH的质量多少克?
根据化学方程式计算的注意事项
1.三个关键
⑴化学式书写要准确
⑵化学方程式要配平
⑶式量计算要准确
2.三个要领
⑴步骤要完整
⑵格式要规范
⑶得数要准确
3.注意事项
⑴计算所用质量应是实际参加反应的纯物质的质量
⑵计算中单位要统一
我的小结我的小结
名称:3.3化学方程式ppt课件(新浙教版八年级下册科学)
学科:科学
类型:PPT课件
年级:初中二年级
版本:浙教版
页数:22张
大小:233.56 KB
格式:pptx
预览图随机显示 6 页,实际是22页PPT。
下载链接中的资源是rar压缩包,解压缩后是ppt文档。
全站资源VIP会员免费下载。
购买之前建议先检测百度网盘链接是否失效。
部分精品课件来自优质公开课PPT,请勿公开传播。